내년 3월 임상 1상 종료 전망
회사 측, “내년 6월 이후 결과 도출될 것으로 예상”
동아쏘시오홀딩스 계열사 에스티팜(대표 김경진)이 개발하고 있는 대장암 신약 후보물질의 임상 1상 시험이 순항하고 있다. 이르면 내년 6월 임상 1상 결과가 나올 것으로 회사 측은 전망하고 있다.
4일 미국 임상등록사이트 클리니컬트라이얼즈에 따르면 에스티팜의 대장암 신약 후보물질 ‘STP1002'의 미국 내 임상 1상이 내년 3월 종료될 것으로 예상되고 있다.
앞서 에스티팜은 2019년 말 미국 식품의약국(FDA)으로부터 STP1002의 미국 임상 1상 시험계획을 승인받은 바 있다. 시험은 지난해 7월에 시작됐으며, 약 30명이 대상자다.
회사 측은 미국 내 임상 1상이 내년 3월에 종료된 후, 3개월 뒤인 6월 경 임상 1상 결과가 도출될 것으로 전망했다.
에스티팜 관계자는 “항암제의 경우 1상이 보통 2년 정도”라면서 “STP1002의 임상 1상은 내년 3월 종료 후 데이터 취합하고 보는 게 3개월 정도 걸리므로, 내년 6월 이후에는 임상 1상 결과가 나올 것으로 보고 있다”고 설명했다.
이어 “임상 2상 시험계획서승인신청 일정의 경우 1상이 끝나봐야 알 수 있을 것”이라면서 “관련 사업 본부에서 준비 중인 것으로 안다”고 덧붙였다.
STP1002는 탄키라제(Tankyrase) 효소를 저해해 암세포 성장을 막는 혁신신약 대장암 치료제다. 기존 대장암 치료제인 머크 ‘얼비툭스’에 치료효과를 보이지 않고, 대장암유발유전자(KRAS) 돌연변이 대장암도 치료할 수 있는 것으로 알려졌다.
또 PARP-1과 PARP-2 저해 기전의 항암제 사용 시 독성과 부작용 문제가 발생하는 것에 비해 STP1002는 대장암 환자 유래 암세포를 이식한 동물시험 모델을 활용해 실시한 4주 반복 전임상 독성평가에서 49~70%의 암세포성장억제(Tumor Growth Inhibitor)가 나타났다고 회사 측은 설명했다.
얼비툭스 등 기존 항암제가 주사제로 개발된 반면 STP1002는 1일 1회 복용하는 경구제로 개발돼 복용 편의성이 높다는 것도 장점으로 꼽힌다.
에스티팜은 의약품 위탁개발생산(CDMO)을 주요 사업으로 하고 있다. 올리고뉴클레오타이드(이하 올리고) 신약 원료의약품(API)과 복제약 API 생산이 주요 매출처다. 최근 올리고 API에 대한 수요가 전 세계적으로 증가하면서 에스티팜이 주목받고 있다. 지난해 연간 올리고 신약 API 매출은 452억원으로 전년에 비해 78.8%나 성장했다.
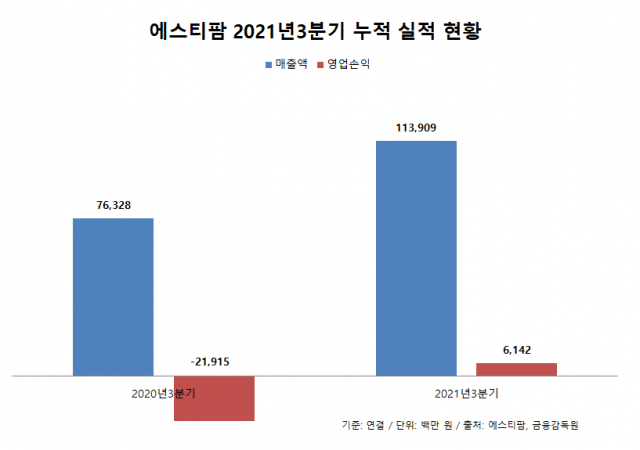
이 회사의 올해 3분기(누적) 연결 기준 잠정 매출액은 약 1139억원, 영업손익 약 61억원을 기록했다. 매출은 작년 동기 대비 49.2% 늘었고 영업손익은 흑자전환했다. 올리고 신약 API 매출 증가가 이를 견인한 것으로 알려졌다.
실적이 증가하면서 현금이 들어오면, 신약 연구개발(R&D)에 재투자할 수 있는 선순환 구조가 마련된다. 현재 에스티팜의 파이프라인 중 임상시험 단계에 진입한 것은 STP1002와 에이즈 신약 후보물질 ‘STP0404'등 2가지다. STP0404는 프랑스에서 임상 1상을 하고 있다.
[CEO스코어데일리 / 김윤선 기자 / yskk@ceoscore.co.kr]



![[현장을 가다] “‘아리아’가 나를 살렸어”…SKT ‘AI 스피커’, 어르신 말동무 이자 ‘보디가드’로 활약](https://www.ceoscoredaily.com/photos/2024/04/01/2024040109491192497_m.jpg)
![[현장을 가다] ‘자동차 메카’에서 ‘전기차 허브’로…현대차 울산공장 가보니](https://www.ceoscoredaily.com/photos/2024/03/22/2024032216190656760_m.jpg)
![[4·10 총선] 野, 금융공약 ‘생계비계좌’ 도입…비트코인 현물 ETF 허용 추진](https://www.ceoscoredaily.com/photos/2024/04/05/2024040517040346372_m.jpg)

![[그래픽] 2022-2023년 6개 카드사 리스자산 추이](https://www.ceoscoredaily.com/photos/2024/04/25/2024042509404783573_m.jpg)
























































































![[24-03호]_500대기업 R&D 투자 현황](https://www.ceoscoredaily.com/photos/2024/04/17/2024041718513086340_m.jpg)

![[이달의 주식부호] 홍라희 여사 2위 탈환…곽동신 한미반도체 부회장 6위로 2계단↑](https://www.ceoscoredaily.com/photos/2024/04/03/2024040314314813956_m.jpg)



![[그래픽] 그레이트 컴퍼니 우수기업 리스트](https://www.ceoscoredaily.com/photos/2023/08/24/2023082410452781615_m.jpg)



댓글
[ 300자 이내 / 현재: 0자 ]
현재 총 0개의 댓글이 있습니다.